
Zespół naukowców z Uniwersytetu Hokkaido opracował metodę umożliwiającą efektywne generowanie reaktywnych rodników z ketonów alkilowych. To istotne osiągnięcie, ponieważ dotychczasowe techniki sprawdzały się głównie w przypadku ketonów arylowych, pozostawiając ich alkilowe odpowiedniki jako nierozwiązany problem syntezy organicznej.
Cząsteczki ketonów nie łączą się przypadkowo
Sedno trudności tkwi w różnicach potencjałów redukcyjnych. Podczas gdy ketony, takie jak acetofenon osiągają wartość -2,11 V, ich alkilowe odpowiedniki – jak cykloheksanon – wymagają aż -2,73 V. Ta pozornie niewielka różnica tworzy w praktyce nieprzekraczalną barierę między reakcją przebiegającą sprawnie a taką, która w ogóle nie zachodzi. Rodniki ketylowe pełnią kluczową rolę jako półprodukty umożliwiające tworzenie wiązań węgiel-węgiel, co stanowi podstawę syntezy skomplikowanych cząsteczek.
Czytaj też: Chemia do poprawki! Ten związek uznawano za niemożliwy do wytworzenia
Kiedy japońscy naukowcy zaczęli analizować problem, szybko zidentyfikowali głównego winowajcę niepowodzeń. Okazało się, że chodzi o zjawisko powrotnego transferu elektronów (BET). W praktyce oznacza to, że rodnik ketylowy powstaje na zbyt krótko, by zdążyć wejść w pożądaną reakcję – zamiast tego oddaje elektron z powrotem do katalizatora palladowego, co cofa cały proces do punktu wyjścia.
Tradycyjne podejście do rozwiązania tego problemu wymagałoby żmudnego testowania tysięcy różnych ligandów fosfinowych, co wiązałoby się z latami pracy, ogromnymi kosztami i znaczną ilością odpadów chemicznych. Zamiast tego zespół postanowił wykorzystać możliwości chemii obliczeniowej. Prof. Wataru Matsuoka i prof. Satoshi Maeda zastosowali opracowaną wcześniej metodę Virtual Ligand-Assisted Screening (VLAS), która pozwala przewidywać zachowanie różnych ligandów jeszcze przed rozpoczęciem laboratoryjnych eksperymentów.
System VLAS przeanalizował 38 ligandów fosfinowych, generując mapę cieplną opartą na właściwościach elektronicznych i sterycznych. Dzięki tym obliczeniom naukowcy mogli wyselekcjonować tylko trzy najbardziej obiecujące związki do testów laboratoryjnych. Optymalny ligand – tris(4-metoksyfenylo)fosfinę oznaczoną jako L4 – znaleźli już przy czwartej próbie, co pokazuje skuteczność obliczeniowego podejścia w porównaniu z tradycyjną metodą prób i błędów.
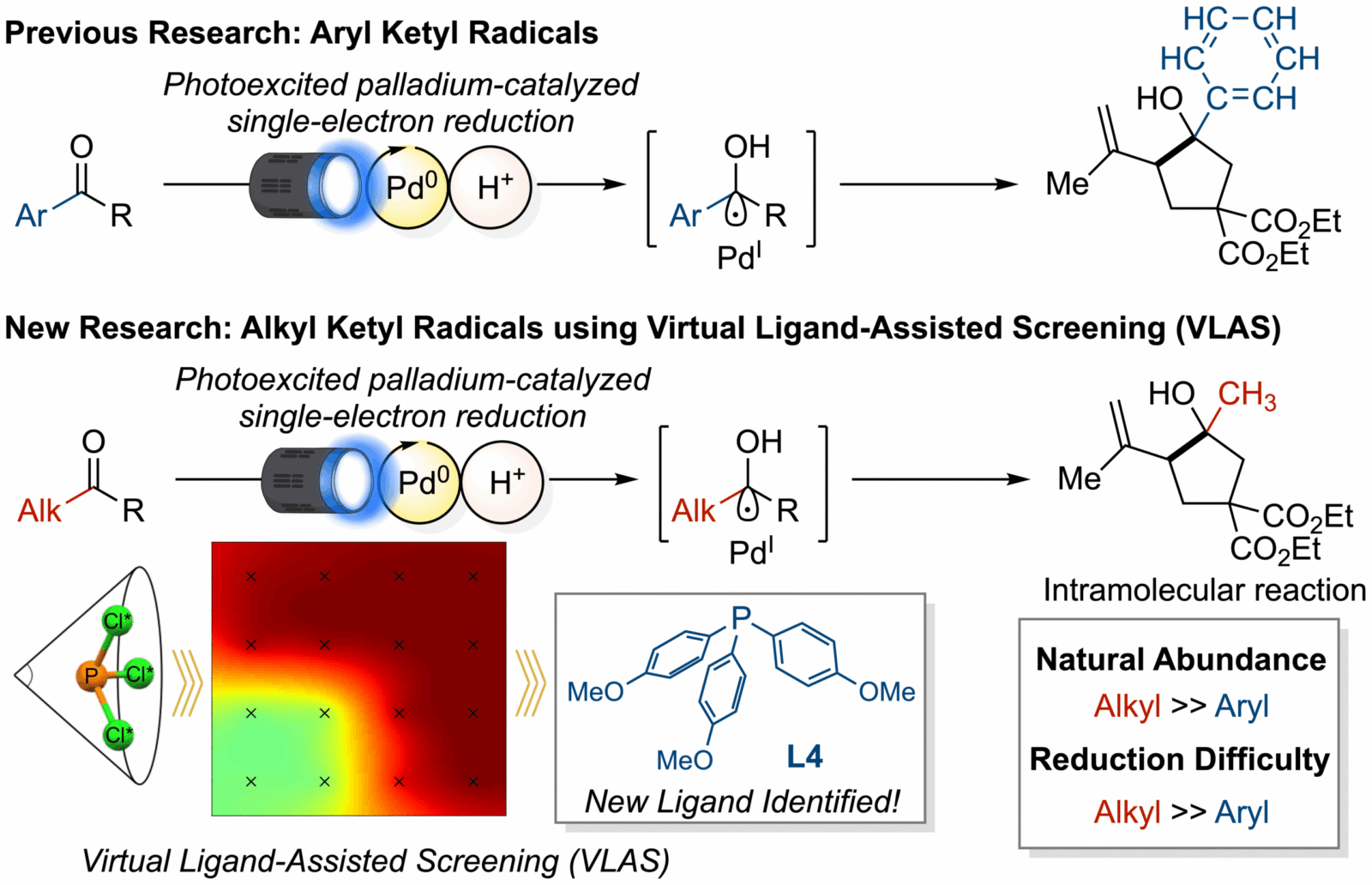
Zastosowanie liganda L4 przyniosło imponujące rezultaty, skutecznie tłumiąc niepożądany powrotny transfer elektronów. Dzięki temu możliwe stało się generowanie rodników ketylowych z ketonów alkilowych i przeprowadzanie reakcji z wysoką wydajnością. System działa w stosunkowo łagodnych warunkach, wykorzystując mrówczan amonu jako źródło kwasu i mieszaninę rozpuszczalników DMI/H2O w proporcji 9:1.
Nowa metoda umożliwia przeprowadzanie różnorodnych transformacji chemicznych, w tym wewnątrzcząsteczkowych cyklizacji redukcyjnych oraz reakcji typu Heck z nieaktywowanymi alkenami i alkinami. To szczególnie istotne, ponieważ te substancje sprawiają ogromne trudności w konwencjonalnych warunkach z użyciem SmI2 – tradycyjnego reduktora stosowanego w tego typu reakcjach.
Kluczowym elementem opracowanej metody jest fotowzbudzona kataliza palladowa, która wykorzystuje światło widzialne do aktywacji reakcji. To połączenie klasycznej chemii metali przejściowych z nowoczesnymi metodami obliczeniowymi tworzy nowy paradygmat w syntezie organicznej. Warto jednak zachować pewien dystans – choć wyniki są obiecujące, prawdziwy test nastąpi, gdy metoda zostanie zweryfikowana w innych laboratoriach i na szerszą skalę.
Osiągnięcie japońskiego zespołu pokazuje szerszą tendencję w współczesnej chemii – rosnącą rolę obliczeń komputerowych w projektowaniu reakcji. Zamiast przeprowadzać setki kosztownych eksperymentów, chemicy mogą teraz wirtualnie przetestować tysiące opcji, wybierając do laboratoryjnej weryfikacji tylko najbardziej perspektywiczne. Dotychczasowe metody były zoptymalizowane głównie dla ketonów arylowych, co ograniczało możliwości syntezy wielu związków. Szczegóły opisano w czasopiśmie Journal of the American Chemical Society.